Toxoplasmose
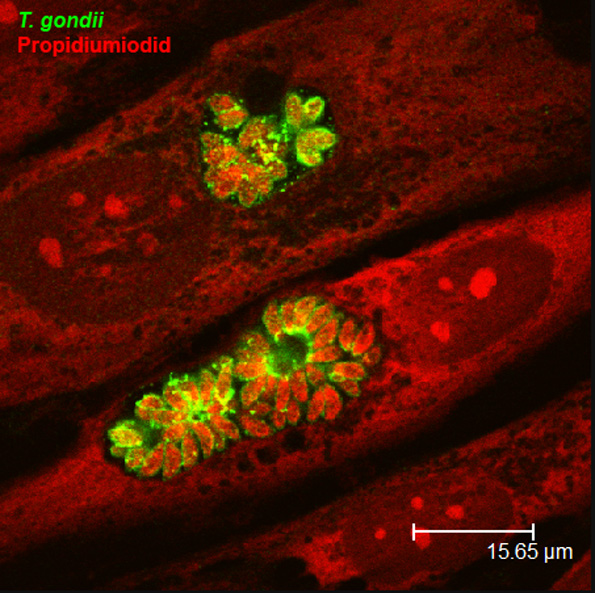
Toxoplasma gondii ist ein weltweit vorkommender intrazellulärer Parasit von Menschen und Tieren; Schätzungen zufolge sind etwa 25-30% der Weltbevölkerung mit dem Parasiten infiziert. Infektionen verlaufen meist subklinisch, allerdings persistiert der Parasit in seinen Wirten lebenslang hauptsächlich in Gehirn und Muskulatur. Personen mit Immunschwäche oder nach Infektion in utero sind dagegen von schweren Krankheitsverläufen bedroht. Aufgrund der hohen Prävalenz zählt T. gondii zu den wichtigsten Lebensmittel-übertragenen Erkrankungen des Menschen.
Forschungsschwerpunkte unserer Arbeiten am Institut für Medizinische Mikrobiologie und Virologie sind die Interaktionen von T. gondii und seinen Wirten, insbesondere die Mechanismen von Immunität und Immunevasion, die Wirtszelltyp-spezifischen Reaktionen während der Infektion, und die Differenzierung unterschiedlicher Parasitenstadien. Unsere Arbeiten sollen helfen, zelluläre und molekulare Mechanismen aufzuklären, die einerseits zur Infektabwehr beitragen und schwere Krankheitsverläufe verhindern, und die es andererseits dem Parasiten ermöglichen, jahrelang persistierende Infektionen zu etablieren (siehe Forschungsprofil AG Lüder).
Ausgewählte Publikationen:
Rahman T, Swierzy IJ, Downie B, Salinas G, Blume M, McConville MJ, Lüder CGK. 2021. The redox homeostasis of skeletal muscle cells regulates stage differentiation of Toxoplasma gondii. Front. Cell. Infect. Microbiol., 11:798549. doi:10.3389/fcimb.2021.798549. [pubmed]
Nast R, Choepak T, Lüder CGK. 2020. Epigenetic control of IFN-γ host responses during infection with Toxoplasma gondii. Front. Immunol., 11:581241. Doi: 10.3389/fimmu.2020.581241. [pubmed]
Garg M, Stern D, Groß U, Seeberger PH, Seeber F, Varon Silva D. 2019. Detection of anti-Toxoplasma gondii antibodies in human sera using synthetic glycosylphosphatidylinositol glycans on a bead-based multiplex assay. Anal. Chem. 2019 Aug 12. doi:10.1021/acs.analchem.9b02154. [pubmed]
Ehmen HG, Lüder CGK. 2019. Long-term impact of Toxoplasma gondii infection on human monocytes. Front. Cell. Infect. Microbiol., 9:235. doi: 10.3389/fcimb.2019.000235. [pubmed]
Pleyer U, Groß U, Schlüter D, Wilking H, Seeber F. 2019. Toxoplasmosis in Germany: Epidemiology, diagnosis, risk factors, and treatment. Dtsch. Arztebl. Int. 2019; 116: 435-44; doi:10.3238/arztebl.2019.0435. [pubmed]
Acar İE, Demirci S, Groß U, Allmer J. 2018. The expressed microRNA-mRNA interactions of Toxoplasma gondii. Front. Microbiol. 2018 Jan 4;8:2630. doi:10.3389/fmicb.2017.02630. [pubmed]
Swierzy IJ, Händel U, Kaever A, Jarek M, Scharfe M, Schlüter D, Lüder CGK. 2017. Divergent co-transcriptomes of different host cells infected with Toxoplasma gondii reveal cell type-specific host-parasite interactions. Scientific Reports 7: 7229. doi:101038/s41598-017-07838-w. [pubmed]
Lüder CGK, Seeber F. 2016. Toxoplasma. In: Walochnik, J. & Duchene, M. (Eds.). Molecular Parasitology: Protozoan Parasites and their molecules. p. 217-239. Springer-Verlag, Wien, Austria.
Swierzy IJ, Lüder CGK. 2015. Withdrawal of skeletal muscle cells from cell cycle progression triggers differentiation of Toxoplasma gondii towards the bradyzoite stage. Cell. Microbiol.17, 2-17. doi: 10.1111/cmi.12342 Epub 2014 Sep 17. [pubmed]
Götze S, Azzouz N, Tsai YH, Groß U, Reinhardt A, Anish C, Seeberger PH, Varón Silva D. 2014. Diagnosis of toxoplasmosis using a synthetic glycosylphosphatidylinositol glycan. Angew. Chem. Int. Ed. Engl. 53: 13701-13705. 10.1002/anie.201406706. [pubmed]
Hotop A, Hlobil H, Groß U. 2012. Efficacy of rapid treatment initiation following primary Toxoplasma gondii infection during pregnancy. Clin. Infect. Dis. 54: 1545-1552. doi: 10.1093/cid/cis234. [pubmed]
Lang C, Hildebrandt A, Brand F, Opitz L, Dihazi H, Lüder CGK. 2012. Impaired chromatin remodelling at STAT1-regulated promoters leads to global unresponsiveness of Toxoplasma gondii-infected macrophages to IFN-g. PLoS Pathog. 8(1), e10002483. doi:101371/journal.ppat.1002483. [pubmed]
Hippe D, Weber A, Zhou L, Chang DC, Häcker G, Lüder CGK. 2009. Toxoplasma gondii infection confers resistance against BimS-induced apoptosis by preventing the activation and mitochondrial targeting of pro-apoptotic Bax. J. Cell Sci. 122, 3511-3521. [pubmed]
Lüder CGK, Stanway R, Chaussepied M, Langsley G, Heussler VT. 2009. Intracellular survival of apicomplexan parasites and host cell modification. Int. J. Parasitol. 39, 163-173. [pubmed]
Vutova P, Wirth M, Hippe D, Gross U, Schulze-Osthoff K, Schmitz I, Lüder CGK. 2007. Toxoplasma gondii inhibits Fas/CD95-triggered cell death by inducing aberrant processing and degradation of caspase 8. Cell. Microbiol. 9, 1556-1570. [pubmed]
Lüder CGK. 2007. Survival strategies of Toxoplasma gondii: Interference with regulatory and effector functions of macrophages. In: Denkers, E.Y. & Gazzinelli R.T. (Eds.). Protozoans in macrophages. p. 130-138. Landes Bioscience, Austin, TX, USA. ISBN: 978-1-58706-150-9.
Lüder CGK, Walter W, Beuerle B, Maeurer MJ, Gross U. 2001. Toxoplasma gondii down-regulates MHC class II gene expression and antigen presentation by murine macrophages via interference with nuclear translocation of STAT1a. Eur. J. Immunol. 31, 1475-1484. [pubmed]
