Forschungsprofil Prof. Dr. med Michael Weig
- Stellvertretender Direktor
- Leitender Oberarzt des Instituts für Medizinische Mikrobiologie und Virologie
- Ringversuchleiter Candida-Serologie (Instand e.V.)
Der Schwerpunkt meiner Laborforschung liegt in der Aufklärung des Aufbaus und der Funktion pilzlicher Zellwände bei humanpathogenen Hefen im Genus Candida. Neben meiner Leidenschaft an Fragesstellungen zur klinischen Mykologie begleite ich in meiner Funktion als leitender Oberarzt klinische Studien zu mikrobiologisch-diagnostischen und infektiologischen Fragestellungen [vollständige Publikationsliste].

Klinisch orientierte Forschung
Globale Bedrohungen der Menschheit, wie das vermehrte Auftreten von multiresistenten und schwer zu therapierenden Infektionserregern oder die im März 2020 von der WHO zur Pandemie erklärte Coronavirus Disease 2019-(COVID-19-) Infektionswelle, führen zu schweren Krankheitsverläufen und verursachen vermehrt Todesfälle. Die Überwindung von solchen infektiologischen Herausforderungen ist nur durch eine sehr enge interdisziplinäre wissenschaftliche Zusammenarbeit zwischen den am Krankbett tätigen Kolleginnen und Kollegen, dem diagnostischen Labor und den Grundlagenforschern möglich. In unserer klinischen Forschungstätigkeit arbeiten wir daher z.B. an der Entwicklung und der Verbesserung diagnostischer Werkzeuge und versuchen die Ursachen für eine verschlechterte Wirksamkeit von Antibiotika und Antimykotika aufzuklären, um verbesserte Therapiestrategien zu ermöglichen.
Ausgewählte Publikationen:
Bender JK, Baufeld E, Becker K, Claus H, Dudakova A, Dörre A, Fila N, Fleige C, Hamprecht A, Hoffmann A, Hogardt M, Kaasch AJ, Kola A, Kriebel N, Layer-Nicolaou F, Marschal M, Molitor E, Mutters NT, Liese J, Nelkenbrecher C, Neumann B, Rohde H, Steinmann J, Sörensen M, Thelen P, Weig M, Zautner AE, Werner G. (2023) CHROMAgar™ LIN-R as an efficient screening tool to assess the prevalence of linezolid-resistant enterococci in German hospital patients-a multicentre study approach, 2021-2022. J Antimicrob Chemother 78(9):2185-2191. doi: 10.1093/jac/dkad218. [Pubmed]
S Dierks, K Thiele, W Bohne, R Lugert, M Weig, U Groß, N von Ahsen, J Schanz, A Fischer, and M Schnelle (2022) Comparison and Harmonization of Different Semi-Automated and Automated qRT-PCR Assays in the Assessment of SARS-CoV-2. Viruses 14(10):2239. doi: 10.3390/v14102239. [Pubmed]
CF Schuster, Weber, M Weig, G Werner, and Y Pfeifer (2022) Ultra-deep long-read sequencing detects IS-mediated gene duplications as a potential trigger to generate arrays of resistance genes and a mechanism to induce novel gene variants such as blaCTX-M-243. J Antimicrob Chemother 77(2):381-390. doi: 10.1093/jac/dkab407. [Pubmed]
G Haase, A Hamprecht, J Held, O. Kurzai, P.-M. Rath, R Schwarz, J Steinmann, O Bader, W Behrens-Baumann, Y Gräser, A Groll, U. Groß, R. Höhl, G. Just-Nübling, C. Lass-Flörl, W Mendling, V Rickerts, H Riechelmann, B Risslegger, M Schaller, E Schmutzhard, K Schröppel, D Theegarten, K Tintelnot, M von Lilienfeld-Toal, J Wagener, G Walther, M Weig (2021) MIQ Pilzinfektionen Teil I und II, [online Version der DGHM]
P Lauermann, M Storch, M Weig, B Tampe, M Winkler, H Hoerauf, N Feltgen, and S Hakroush (2020) There is no intraocular affection on a SARS-CoV-2 – Infected ocular surface. Am J Ophthalmol Case Rep. 20:100884. doi: 10.1016/j.ajoc.2020.100884. [Pubmed]
M Kuhns, A Rosenberger, O Bader, U Reichard, U Gross, and M Weig (2015) Incidence of Candidaemia Following Abdominal Surgery in German Hospitals. Zentralbl Chir. 2140(6):617-23. doi: 10.1055/s-0033-1350814. [Pubmed]
M Weig, U Groß, and O Bader (2015) Epidemiologie der Azolresistenz bei Aspergillus fumigatus in Deutschland. Der Mikrobiologe 25
Arbeiten zur Zelloberfläche von Candida
Die humanpathogenen Hefen Candida albicans und Candida glabrata stehen in der westlichen Welt an der Spitze der häufigsten Verursacher von systemischen Pilzinfektionen. Vor allem C. glabrata zeichnet sich dabei durch eine hohe Rate an Resistenzen gegenüber gängigen antimykotischen Wirkstoffen und einer ausgeprägten Biofilmbildung auf verschiedensten Substraten aus, und steht damit stark im klinischen Fokus.
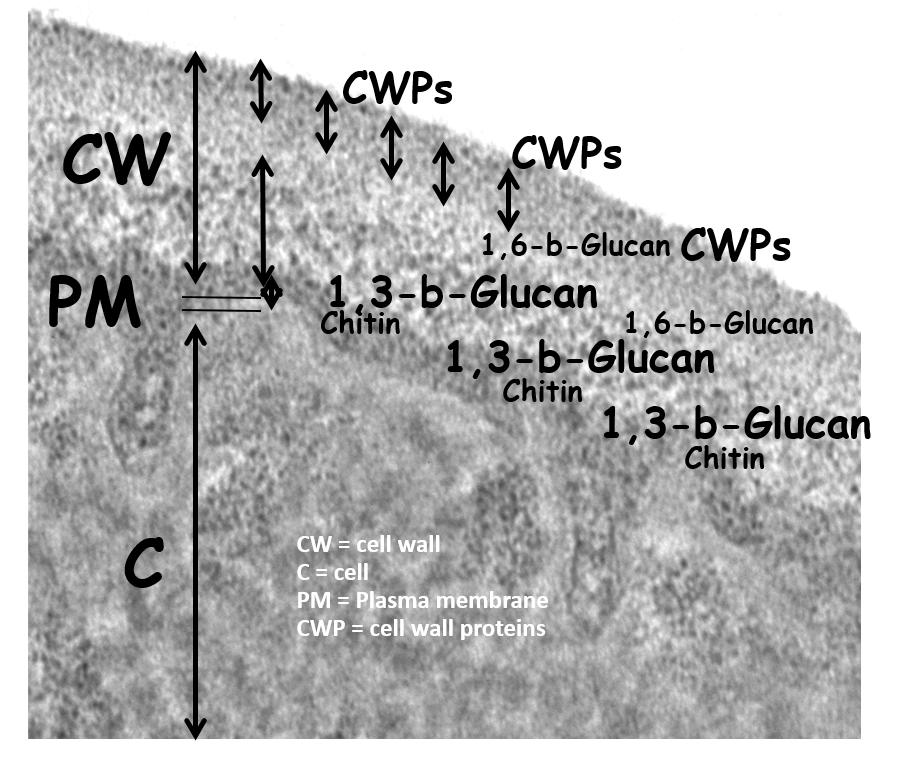
Die Fähigkleit Biofilme zu bilden ist direkt abhängig von der Beschaffenheit der Zelloberfläche, die im Genus Candida im Wesentlichen aus einer Zellwand aus Glukan und Chitin und darauf verankerten Proteinen (Effektoren) besteht. Mit meinem Team und internationalen Kooperationspartnern (v.a. Prof. PW deGroot) konnten wir detailliert die Zusammensetzung der Zellwand aufschlüsseln und erstmalig einen wesentlichen Teil des Zellwandproteoms massenspektrometrisch beschreiben. Dabei zeigte sich, dass C. glabrata über ein ungewöhnlich großes Repertoire an Adhäsinen verfügt welche hauptsächlich in den Telomerregionen des Pilzegenoms kodiert sind.
Über die Funktionalität bei Besiedelung und Infektion hinaus stellt die Zellwand ein wichtiges diagnostisches Target dar. Neben den Polysacchariden, welche durch die angeborene Immunität erkannt werden können, stellen auf der Zelloberfläche verankerte oder sezernierte Proteine diagnostische Marker dar. Zu diesem Themenkomplex leiten wir zusammen mit Instand e.V. den zwei mal im Jahr stattfindenden Ringversuch zur Candida-Serologie.
Ausgewählte Publikationen:
C Vaz, A Pitarch, E Gómez-Molero, A Amador-García, M Weig, O Bader, L Monteoliva, and C Gil (2021) Mass Spectrometry-Based Proteomic and Immunoproteomic Analyses of the Candida albicans Hyphal Secretome Reveal Diagnostic Biomarker Candidates for Invasive Candidiasis. J Fungi 7(7):501. doi: 10.3390/jof7070501. [Pubmed]
E Gómez-Molero, AD de Boer, HL Dekker, A Moreno-Martínez, EA Kraneveld, Ichsan, N Chauhan, M Weig, JJ de Soet, CG de Koster, O Bader, and PW de Groot (2015). Proteomic analysis of hyperadhesive Candida glabrata clinical isolates reveals a core wall proteome and differential incorporation of adhesins. FEMS Yeast Res 15(8). doi: 10.1093/femsyr/fov098. [Pubmed]
PW de Groot, O Bader, AD de Boer, M Weig, and N Chauhan (2013). Adhesins in human fungal pathogens: glue with plenty of stick. Eukaryot Cell 12(4):470-81. doi: 10.1128/EC.00364-12. [Pubmed]
CM Hull, O Bader, JE Parker, M Weig, U Gross, AG Warrilow, DE Kelly, and SL Kelly (2012). Two clinical isolates of Candida glabrata exhibiting reduced sensitivity to amphotericin B both harbor mutations in ERG2. Antimicrob Agents Chemother 56(12):6417-21. [Pubmed]
O Bader, A Schwarz, EA Kraneveld, M Tangwattanchuleeporn, P Schmidt, MD Jacobsen, U Groß, PWJ de Groot, and M Weig (2012). Gross karyotypic and phenotypic alterations among different progenies of the Candida glabrata CBS138/ATCC2001 reference strain. PLoS One 7(12):e52218. [Pubmed]
AD de Boer, PW de Groot, G Weindl, M Schaller, D Riedel, R Diez-Orejas, FM Klis, CG de Koster, HL Dekker, U Groß, O Bader, and M Weig (2010). The Candida albicans cell wall protein Rhd3/Pga29 is abundant in the yeast form and contributes to virulence. Yeast 27:611-24. [Pubmed]
PW deGroot, EA Kraneveld, QY Yin, HL Dekker, U Gross, W Crielaard, CG de Koster, O Bader, FM Klis and M Weig (2008). The cell wall of the human pathogen Candida glabrata: differential incorporation of novel adhesin-like wall proteins. Eukaryot Cell 7:1951-64. [Pubmed]
